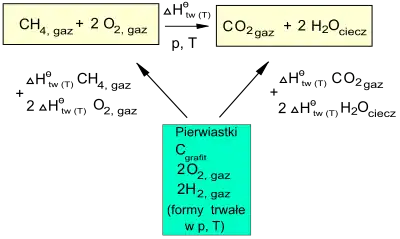
Przykład obliczeń standardowego ciepła reakcji na podstawie standardowych ciepeł tworzenia reagentów (zastosowanie prawa Hessa)
Prawo Hessa, zwane też prawem stałej sumy ciepeł, sformułowane w 1840 r. przez Germana Hessa mówi, że:
- Ciepło reakcji chemicznej przebiegającej w stałej objętości lub pod stałym ciśnieniem nie zależy od tego jaką drogą przebiega reakcja, a jedynie od stanu początkowego i końcowego.
Oznacza to, że ciepło reakcji nie zależy od tego, czy produkty otrzymano z substratów bezpośrednio czy poprzez dowolne etapy pośrednie. Jeżeli w trakcie reakcji nie występuje praca użyteczna, wówczas ciepło przemiany będzie zależało jedynie od stanu początkowego i końcowego.
Prawo Hessa jest konsekwencją prawa zachowania energii w reakcjach chemicznych.
Prawo Hessa pozwala w pośredni sposób wyznaczyć wielkości termodynamiczne, których nie da się zmierzyć doświadczalnie, np. standardowych wartości ciepła tworzenia węglowodorów, na podstawie łatwych do zmierzenia ciepeł spalania.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.