Próba Lehnera – reakcja charakterystyczna, wykonywana najczęściej podczas analizy kationów i anionów w roztworach wodnych, dzięki której można wykryć aniony chromianowe (CrO42-) i dichromianowe (Cr2O72-).
Wykonanie i reakcje
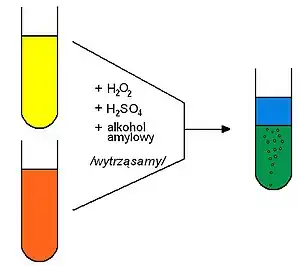
Do probówki należy wlać niewielką ilość (3 ml) badanego roztworu zawierającego żółte aniony chromianowe i/lub pomarańczowe aniony dichromianowe, dodajemy kilka kropli nadmiaru wody utlenionej (3%), kilka kropli roztworu kwasu siarkowego o stężeniu ok. 3 mol/dm3 oraz cienką warstwę (ok. 1 ml) alkoholu amylowego. Probówkę zatyka się i wytrząsa silnie przez kilkadziesiąt sekund. Po wytrząśnięciu i odczekaniu kilku sekund, widać w probówce dwie wyraźnie oddzielone warstwy roztworów: górna (alkoholowa) i dolna (wodna), ponieważ alkohol amylowy i woda nie mieszają się wzajemnie ze sobą. Można więc poczynić następujące obserwacje:
- w górnej (alkoholowej) warstwie, widać niebieskie zabarwienie roztworu pochodzące od wyekstrahowanego nietrwałego kwasu nadchromowego (H2CrO6), lub odpowiadającego mu bezwodnika – nadtlenku chromu (CrO5).
Pamiętając, że w roztworze po dodaniu kwasu siarkowego ustala się równowaga między chromianami i dichromianami:
- 2CrO42-(żółty) + 2H+ ↔ Cr2O72-(pomarańczowy) + H2O
zapis reakcji zachodzących w tej warstwie (powodujących jej niebieskie zabarwienie) można przedstawić następująco:
- Dla chromianów:
- CrO42-(żółty) + 2H2O2 + 2H+ → H2CrO6(niebieski) + 2H2O
- Dla dichromianów:
- Cr2O72-(pomarańczowy) + 4H2O2 + 2H+ → 2H2CrO6(niebieski) + 3H2O
- W dolnej (wodnej) warstwie, widzimy intensywne wydzielanie się gazu (tlen) i stopniowo pojawiającą się zieloną barwę roztworu, spowodowaną obecnością jonów chromowych(III). Zapis reakcji zachodzącej w tej warstwie (powodującej jej zielone zabarwienie i wydzielanie się gazu) można przedstawić następująco:
- Cr2O72-(pomarańczowy) + 3H2O2 + 8H+ → 2Cr3+(zielony) + 3O2↑ + 7H2O
Bibliografia
- M. Żołnowski: Nieorganiczna chemia analityczna. Część 1: Kationy. skrypt AM Warszawa.