| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny |
C10H12N5O6P | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
329,21 g/mol | ||||||||||||||
| Wygląd | |||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS |
60-92-4 | ||||||||||||||
| PubChem | |||||||||||||||
| DrugBank | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||
Cykliczny adenozyno-3′,5′-monofosforan (cAMP) – organiczny związek chemiczny z grupy nukleotydów, cykliczna pochodna adenozyno-5′-monofosforanu (cykliczny diester kwasu fosforowego). Bierze udział w wielu reakcjach biochemicznych jako element transdukcji sygnału.
Związek ten jest wykorzystywany przez komórki jako jeden z przekaźników II rzędu. Pobudzenie niektórych receptorów błonowych komórek prowadzi do uruchomienia enzymu zwanego cyklazą adenylową, który wytwarza cząsteczki cAMP z ATP. Cząsteczki cAMP łączą się z różnymi białkami komórki i wpływają na wiele różnych procesów życiowych oraz na aktywność różnych genów.
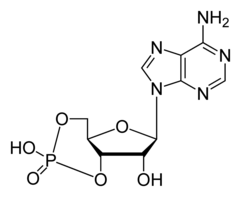
Budowa cAMP
cAMP – cykliczny adenozynomonofosforan jest nukleotydem składającym się z adeniny, rybozy i fosforanu. Nukleotydy są fosforanowymi pochodnymi nukleozydów, które są połączeniem zasady azotowej z pentozą. Wiązanie estrowe łączy resztę ortofosforanową (V) przy węglu 5′ rybozy z grupą hydroksylową przy węglu 3′ tej samej cząsteczki rybozy. W skrócie nazwę cyklicznego nukleotydu tworzy się umieszczając literkę „c” przed skrótem nazwy nukleotydu.
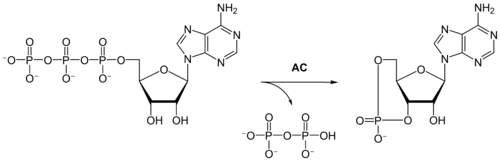
Biosynteza cAMP
Cykliczny AMP powstaje w drodze cyklizacji ATP, katalizowanej przez cyklazę adenylanową (AC)[4]:
Funkcje cAMP
- Aktywuje swoiste kinazy białkowe, które działają stymulująco na poszczególne enzymy i białka.
- Aktywacja kinaz odbywa się poprzez łącznie cAMP z ich częścią regulatorową. Kinazy te następnie stymulują enzymy i białka regulatorowe w chromatynie jądrowej, powodując ich fosforylację. Przykładem może być proces glikolizy i tlenowe przemiany ufosforylowanych monoz, zachodzące dzięki przekształcaniu się glukozy w glukozo-6-fosforan spowodowanym glukokinazą. Aktywne kinazy niezależne od cAMP odgrywają kluczową rolę w powstawaniu odpowiedzi komórkowej.
- Zwiększa przepuszczalność błon komórkowych
- cAMP uwalnia jony Ca2+ z kompleksu ATP-Ca2+ i powoduje przemieszczenie innych jonów, co jest przyczyną zwiększenia przepuszczalności błon komórkowych.
- Jest informatorem drugiego rzędu pośredniczącym w działaniu wielu hormonów (np. noradrenaliny, glukagonu):
- Układy umiejscowione w błonie komórkowej i uczestniczące w przeniesieniu informacji z jej zewnętrznej strony do wnętrza komórki określa się jako układy transdukcji. Mechanizm funkcjonowania systemu transdukcji obrazuje hipoteza tzw. wtórnego przekaźnika (cAMP), zgodnie z którą w działaniu hormonu na komórkę można wyróżnić cztery etapy: rozpoznanie informacji, przeniesienie jej, transmisja i odpowiedź.
- Hormon (H)- pierwszy przekaźnik wiąże się z receptorem na zewnętrznej stronie błony komórkowej. Pod wpływem kompleksu hormon-akceptor następuje zmiana konformacyjna w białku sprzęgającym G tak, że jest ono zdolne do oksydacji domeny występującej po wewnętrznej stronie plazmolemy. Gdy efektorem jest cyklaza adenylanowa (CA) prowadzi to do zwiększenia przepuszczalności cAMP pełniącego rolę drugiego przekaźnika. Związek ten powoduje przekształcenie nieaktywnej kinazy białkowej (kn) w jej aktywna postać (Ka). Następnie kinaza ta przez fosforylację aktywuje kolejny enzym (en i Ea – odpowiednio nieaktywna i aktywna postać enzymu), co wywołuje ciąg następnych reakcji związanych z wystąpieniem ostatecznej odpowiedzi komórkowej.
- Jest kluczowym związkiem integrującym regulację rozpadu i syntezy glikogenu.
- Zwiększony poziom cAMP uruchamia serię reakcji, które powodują aktywację fosforylazy, a równocześnie hamują działanie syntezy glikogenowej. Aktywacja fosforylazy polega na fosforylacji specyficznych reszt seryny przez kinazę fosforylazy glikogenu. Fosforylaza w mięśniu jest aktywowana przez adrenalinę za pośrednictwem cAMP. Zwiększenie poziomu cAMP aktywuje następnie kinazę białek zależną od cAMP, która katalizuje, z udziałem ATP, fosforylację nieaktywnej kinazy b fosforylazy do aktywnej kinazy a fosforylazy. Z kolei kinaza a w wyniku kolejnej fosforylacji aktywuje fosforylazę b do fosforylazy a. Wykazano również, że aktywność fosforylazy a tym samym nasilenie glikogenolizy w mięśniach są zsynchronizowane z przejściowym wzrostem stężenia Ca2+ w cytoplazmie oraz ze skurczem mięśni. Rozpad glikogenu w mięśniach zwiększa się kilkaset razy bezpośrednio po rozpoczęciu jego skurczu. Obserwuje się wówczas uwolnienie jonów wapnia, które powodują szybką aktywację kinazy fosforylazy.
- Przyspiesza przemiany w cyklu kwasów trikarboksylowych, wzmaga utlenianie komórkowe i syntezę ATP.
- Stymuluje wzrost ruchliwości plemników.
- Duża zawartość cAMP w plemniku koreluje z dobrą ruchliwością tych komórek, co ma uzasadnienie w kontroli aktywności tubuliny. Wzrost ruchliwości plemników, stymulowany przez cAMP, powoduje zmniejszenie wewnątrzkomórkowego ATP i tym samym przyśpiesza metabolizm komórkowy.
- Wpływa na przemianę lipidów.
- Hormony powodujące wyraźne przyspieszenie liolizy (np. aminy katecholowe, adrenalina, noradrenalina), czynią to przez pobudzenie aktywności cyklazy adenylanowej, enzymu przekształcającego ATP w cAMP. Mechanizm ten jest analogiczny do warunkującego stymulację hormonalną glikogenolizy. cAMP przez stymulację kinazy białek przekształca nieaktywną, wrażliwą na hormon, lipazę triacyloglicerolową w jej formę aktywną. Tak więc stężenie liolizy jest głównie kontrolowane przez ilość cAMP w tkance. Procesy, które powodują rozkład tego nukleotydu lub chronią go przed rozkładem, wywierają wpływ na lipolizę. cAMP jest przekształcany w 5′-AMP przez fosfodiestrazę cyklicznego 3′5′-nukleotydu. Aktywność tego enzymu jest hamowana przez pochodne ksantyny, takie jak kofeina i teofilina. Wiadomo, że picie kawy lub podawanie kofeiny powoduje u ludzi wyraźny i długotrwały wzrost stężenia WKT (wolnych kwasów tłuszczowych) w osoczu krwi.
- Zwiększa glikogenolizę wątrobową i jest sygnałem głodu.
- Podwyższenie poziomu cAMP, np. pod wpływem adrenaliny, zwiększa aktywność kinazy białkowe zależnych od cAMP, które regulują poziom glukozy poprzez aktywację kinazy fosforylazowej i jednoczesną dezaktywację syntetazy glikogenowej. W przypadku niedoboru glukozy we krwi, trzustka wydziela glukagon, który stymuluje syntezę cAMP i zgodnie z powyższym mechanizmem, pobudza glikogenolizę w wątrobie. Przy wysokim stężeniu glukozy trzustka wydziela natomiast insulinę, która ma działanie przeciwne do glukagonu i obniża poziom cAMP[5].
- cAMP w wielu indukowanych operonach może stymulować inicjację transkrypcji i służyć jako sygnał głodu np. u bakterii i ssaków.
Rozkład cAMP
Po spełnieniu swej funkcji cAMP ulega przekształceniu w 5’AMP dzięki zawartej w błonach fosfodiestrazie nukleotydów cyklicznych PDE. Aktywność enzymu jest uzależniona od obecności grup tiolowych -SH i jonów dwuwartościowych.
Zobacz też
Przypisy
- ↑ Adenosine 3′,5′-cyclic monophosphate. Product Specification [online], Sigma-Aldrich, 4 kwietnia 2011 [dostęp 2023-09-04] (ang.).
- 1 2 Adenosine cyclic phosphate, [w:] PubChem, United States National Library of Medicine, CID: 6076 [dostęp 2023-09-04] (ang.).
- ↑ Cyclic AMP, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2012-07-12] (ang.).
- ↑ Adenylate cyclase. Enzyme entry: EC 4.6.1.1, [w:] Enzyme nomenclature database, SIB Swiss Institute of Bioinformatics (ang.).
- ↑ Lubert Stryer: Biochemia. Wyd. 1. Warszawa: PWN, 1986, s. 398–400; 570–572. ISBN 83-01-00140-2.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.