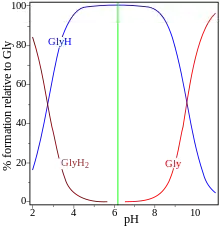
Populacje różnych form przykładowego amfolitu, glicyny, w zależności od pH roztworu. Zielona linia wskazuje punkt izoelektryczny.
GlyH2: kation H3N+CH2COOH
GlyH: zwitterjon H3N+CH2COO−
Gly: anion H2NCH2COO−
GlyH2: kation H3N+CH2COOH
GlyH: zwitterjon H3N+CH2COO−
Gly: anion H2NCH2COO−
Amfolity, substancje amfiprotyczne, elektrolity amfoteryczne – związki chemiczne, których cząsteczki zawierają zarówno grupy kwasowe, jak i zasadowe. Uogólniając, zgodnie z teorią Brønsteda, amfolitami są substancje, które w reakcjach w roztworze mogą przyłączać bądź odłączać protony. Amfolity w zależności od pH środowiska w którym się znajdują mogą występować w postaci:
- amfijonów (jonów obojnaczych, zwitterjonów) – środowisko obojętne
- kationów – środowisko kwasowe
- anionów – środowisko zasadowe
Przykładem amfolitów są aminokwasy lub woda.
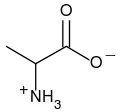
Przykładowy amfolit: alanina, H3N+(CH3)CHCOO−
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.